【JACS】清华大学储凌课题组-荧光成像新选择,自恢复蛋白标签
Protein Tag
蛋白标签
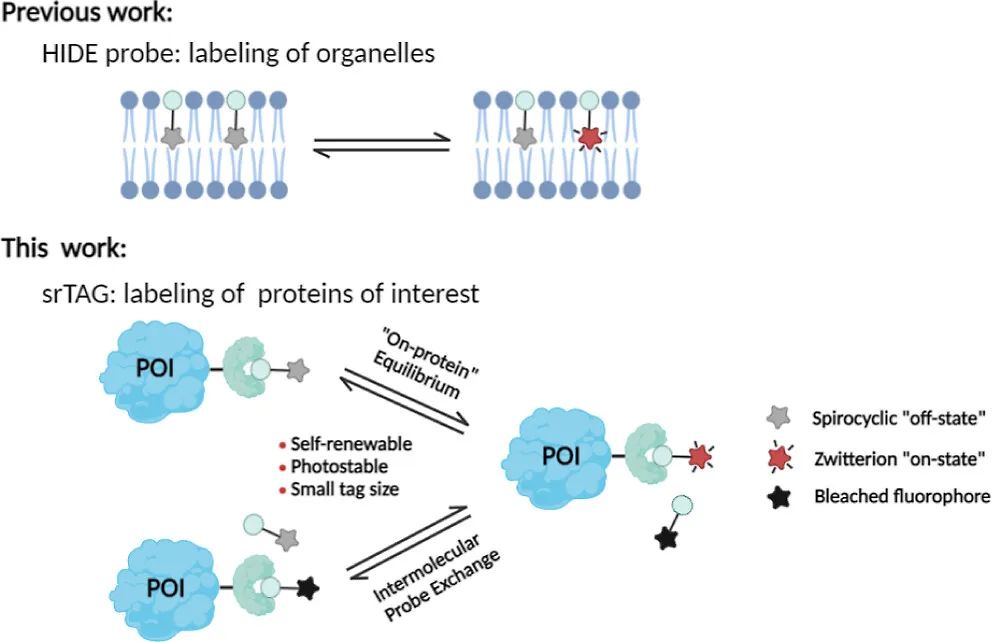
这篇文章介绍了一种新型的自我更新标签(srTAG),用于蛋白质的荧光成像。这种标签具有自我修复的能力,可以在光漂白后自我恢复荧光,从而实现更长时间的成像。此外,这种标签还具有与不同光谱特性兼容的优点,可以用于不同细胞环境或生物体中的蛋白质成像。该研究为生物成像领域的发展提供了新的思路和方法。
初探
首先,作者探讨了 HIDE 探针的概念是否可以扩展到蛋白质标签。他们推测,如果硅基罗丹明的“开/关”平衡在荧光探针与蛋白质标签结合时仍然存在,那么光漂白将使“开/关”平衡向氨基酸离子“开启”方向转移。为了验证这一假设,作者将携带Halo-mEmerald-NLS或SNAP-mEmerald-NLS的质粒转染到U2OS细胞中,固定后,与JF635-CA或JF635-BG一同孵育,结果,作者没有观察到这两种标记的荧光信号恢复,作者推测,具有不同表面性质的蛋白质可能会影响染料 "开/关 "平衡的动力学,从而改变 "蛋白质 "荧光团的 "开/关 "切换。于是,作者考虑使用分子量相对较小的小分子,于是选取了AP1867 分子作为研究对象,因为AP1867能优先地与FK506 结合蛋白(FKBP)F36V 突变体结合,而不是野生型 FKBP12。首先,作者将荧光剂 JF635 与 AP1867 偶联合成了 ZCD-1(图 1A),并用U2OS细胞进行了 FRAP 实验。令人欣慰的是,用 ZCD-1 孵育并对细胞核中的 ROI 进行光漂白后,荧光信号恢复到初始荧光强度的 65%,恢复半衰期为 175.8 ± 34.7 s。当ZCD-1与表达FKBPF36L突变体标记的U2OS细胞一起孵育时,最大恢复比提高到85%,恢复半衰期为199.3 ± 23.5秒(图2B、C),这些结果表明,将染料与Ariad配体结合不会显著影响它们与FKBP突变体的结合亲和力。为了进一步证明srTAG自我恢复荧光的能力,作者进行了三重光漂白实验。而即使在第三次光漂白后,被漂白的荧光信号仍然可以恢复到初始荧光强度的63%(图2E)。而这种新标签可以广泛应用于标记细胞内的蛋白(图2D)。 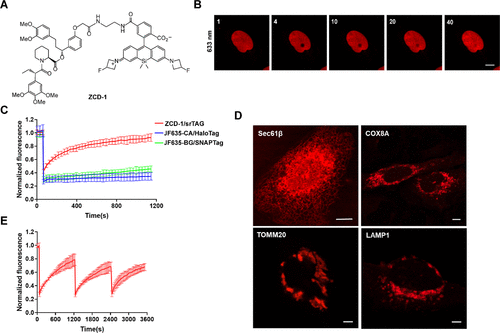 图1.srTAG 在光漂白后会自发恢复荧光信号。(A) ZCD-1 的化学结构。(B) 在 U2OS 细胞中,光漂白后的荧光恢复(30 秒/帧,共 40 帧)。(C)用 JF635-CA/Halo、JF635-BG/SNAP 和 ZCD-1/FKBPF36V 标记的 U2OS 细胞的归一化荧光强度随时间变化图 。(D) U2OS 细胞中ER 定位的 Sec61β、线粒体内膜定位的 COX8A、线粒体外膜定位的 TOMM20 和溶酶体定位的 LAMP1 的共聚焦图像。(E)三重漂白实验中 srTAG 随时间变化的归一化荧光强度曲线图。
图1.srTAG 在光漂白后会自发恢复荧光信号。(A) ZCD-1 的化学结构。(B) 在 U2OS 细胞中,光漂白后的荧光恢复(30 秒/帧,共 40 帧)。(C)用 JF635-CA/Halo、JF635-BG/SNAP 和 ZCD-1/FKBPF36V 标记的 U2OS 细胞的归一化荧光强度随时间变化图 。(D) U2OS 细胞中ER 定位的 Sec61β、线粒体内膜定位的 COX8A、线粒体外膜定位的 TOMM20 和溶酶体定位的 LAMP1 的共聚焦图像。(E)三重漂白实验中 srTAG 随时间变化的归一化荧光强度曲线图。
验证
为评估探针的光稳定性,作者以每帧10秒的速度进行延时共聚焦成像,并测量100帧细胞核的荧光强度。令人满意的是,与reHaloTagF相比,srTAG 表现出相似的光稳定性,但与HaloTag相比,srTAG的漂白半衰期改善了约2.4倍,与SNAP标签相比改善了约6.7倍(图2A–C)。ER标记物Sec61β的成像进一步证明了srTAG优越的光稳定性,与Sec61β-Halo相比,在共聚焦显微镜下成像时,使用Sec61β-srTAG标记的ER显示出约2.7倍的延长漂白半衰期。此外,对ZCD-1的光稳定性在不同的成像频率下进行了评估,正如基于平衡的荧光恢复机制所预期的那样,在较高的采集频率下进行共聚焦成像会缩短 srTAG 的漂白半衰期(图 2D, E)。 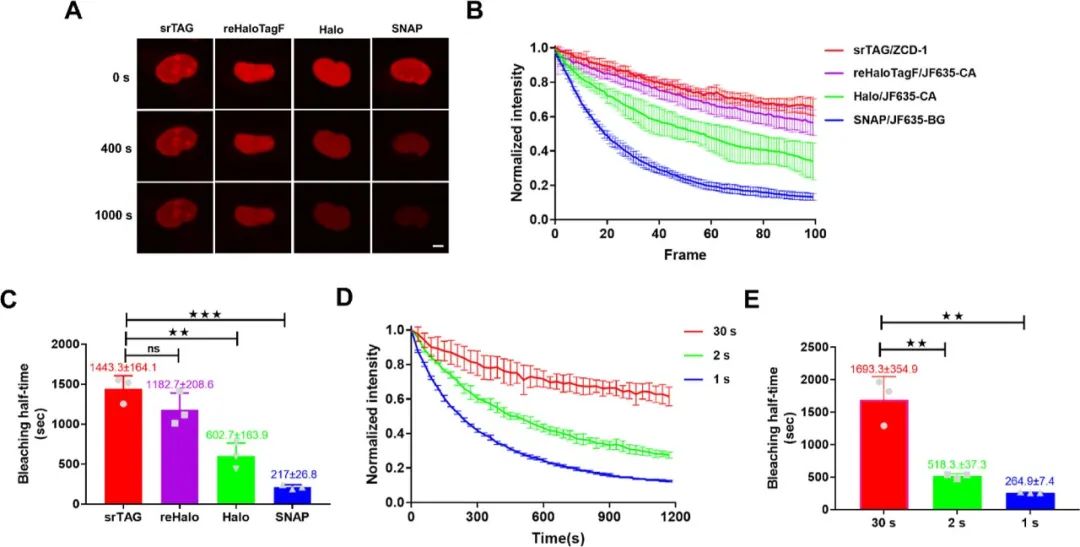 图2.srTAG 可实现长延时荧光成像。(A) U2OS 细胞核的时程图像。(B) 不同活细胞核成像的归一化荧光强度随时间变化图。(C) 根据(B)中光漂白曲线的单指数拟合计算的漂白半衰期。(D)不同成像频率下 srTAG 的归一化荧光强度随时间变化图。(E)根据(D)中光漂白曲线的单指数拟合计算的漂白半衰期。
图2.srTAG 可实现长延时荧光成像。(A) U2OS 细胞核的时程图像。(B) 不同活细胞核成像的归一化荧光强度随时间变化图。(C) 根据(B)中光漂白曲线的单指数拟合计算的漂白半衰期。(D)不同成像频率下 srTAG 的归一化荧光强度随时间变化图。(E)根据(D)中光漂白曲线的单指数拟合计算的漂白半衰期。
为了测试ZCD-1的“蛋白内”平衡是否是普遍现象,作者合成了ZCD-7和ZCD-8并进行了相同的FRAP实验(图3A,C)。令人满意的是,无论ZCD-7还是ZCD-8都能在光漂白后恢复荧光,ZCD-7具有较快的恢复速率,半衰期为26.5 ± 1.0秒,而ZCD-8的恢复速率与ZCD-1相当,半衰期为141.9 ± 14.1秒。作者还在共聚焦成像条件下对表达FKBPF36L融合核、内质网和线粒体的U2OS细胞进行了活细胞成像(图3B、D)。 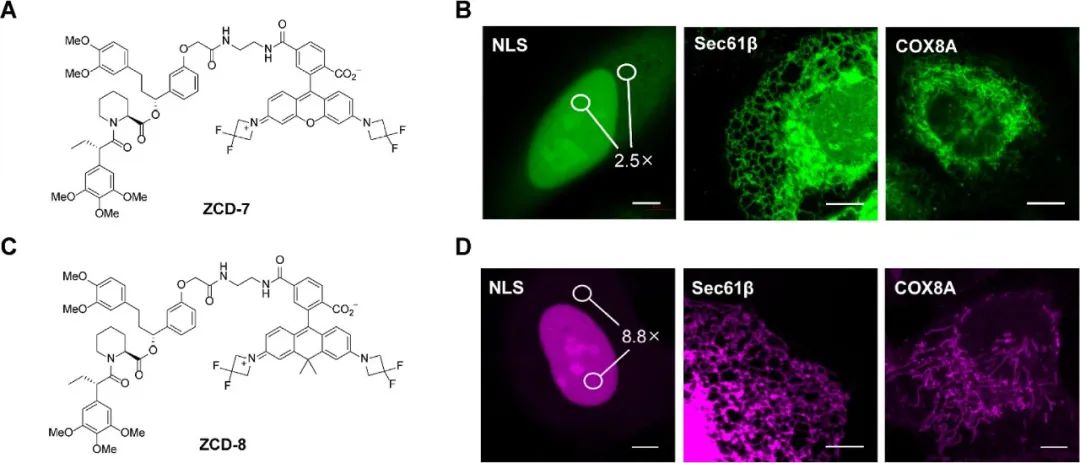 图3. 使用带有不同光谱特性荧光团的 srTAG 进行活细胞成像。(A) ZCD-7 的化学结构。(B) U2OS 细胞中细胞核定位的 NLS、ER 定位的 Sec61β 和线粒体定位的 COX8A 的共聚焦图像。(C) ZCD-8 的化学结构。(D) U2OS 细胞中细胞核定位的 NLS、ER 定位的 Sec61β 和线粒体定位的 COX8A 的共聚焦图像。
图3. 使用带有不同光谱特性荧光团的 srTAG 进行活细胞成像。(A) ZCD-7 的化学结构。(B) U2OS 细胞中细胞核定位的 NLS、ER 定位的 Sec61β 和线粒体定位的 COX8A 的共聚焦图像。(C) ZCD-8 的化学结构。(D) U2OS 细胞中细胞核定位的 NLS、ER 定位的 Sec61β 和线粒体定位的 COX8A 的共聚焦图像。
超分辨荧光成像与机理
为了展示srTAG在超分辨率显微镜下的应用价值,作者在U2OS细胞中进行了活细胞STED成像(图4A、B)。作者获得了具有半峰全宽(FWHM)分别为67 ± 16、73 ± 20和72 ± 18纳米的F-actin和具有FWHM为69 ± 19、68 ± 21和65 ± 16纳米的ER管的STED图像(图4A–C),证明了srTAG与超分辨率成像实验的兼容性。活细胞STED ER的时间序列成像展示了srTAG的卓越光稳定性(图4D)。通过JF635-CA和ZCD-8标记的reHaloTagF-Sec61β和Lifeact-FKBPF36L的双色STED成像示例,显示了srTAG与其他可交换标签的兼容性,可用于进行多色成像实验(图4E)。 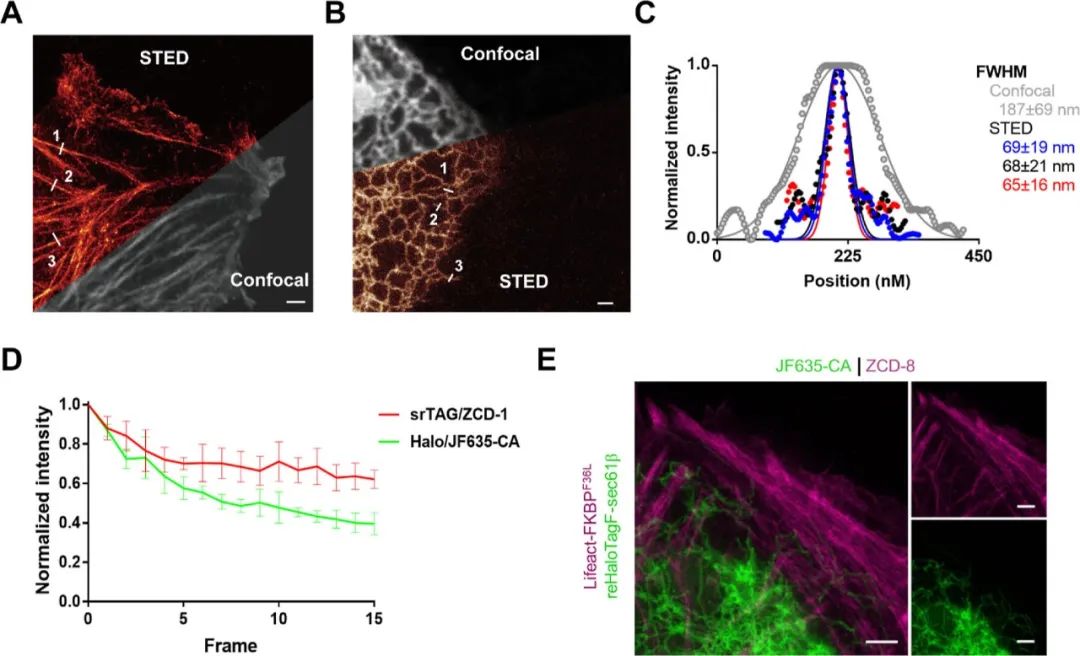
图4. srTAG 在活细胞蛋白质特异性成像中的应用。(A) 表达 Lifeact-FKBPF36L 的 U2OS 活细胞中 ZCD-1 的共焦和 STED 成像。(B) U2OS 细胞中ER定位的 Sec61β 的共焦和 STED 图像。(C)STED 和共聚焦图像中的荧光信号与(B)中线段位置的函数关系图。(D)带有不同自标记标签的ER活细胞STED成像的归一化荧光强度随时间变化图
荧光信号的恢复可能是由于荧光分子在蛋白质上的“开启/关闭”平衡或非共价探针的可交换性质。为了阐明这一机制,作者纯化了重组FKBPF36L蛋白并将FKBPF36L/ZCD-1复合物固定在玻片上。通过全内反射荧光显微镜(TIRF)监测FRAP实验。结果作者一直观察到在无游离扩散的ZCD-1的情况下荧光恢复,证实了荧光分子在蛋白质上的“开启/关闭”平衡有助于荧光恢复。作为对照,纯化的Halo/JF635-CA复合物在光漂白后没有恢复荧光信号(图5A)。另一方面,为了调查探针交换是否也有助于FRAP现象,作者首先将表达NLS-FKBPF36L的U2OS细胞与ZCD-1一起孵育,然后用含有ZCD-7的培养基替换培养基。如图5B所示,ZCD-1探针被ZCD-7替换,532 nm通道中出现荧光信号,633 nm通道中信号减弱。此外,我们在无洗涤或洗去探针的条件下比较了srTAG的光稳定性。与用不含探针的PBS替换培养基的“洗去”组相比,“无洗涤”组表现出更高的光稳定性。这些实验表明,探针交换也有助于观察到的FRAP现象和改善的光稳定性。
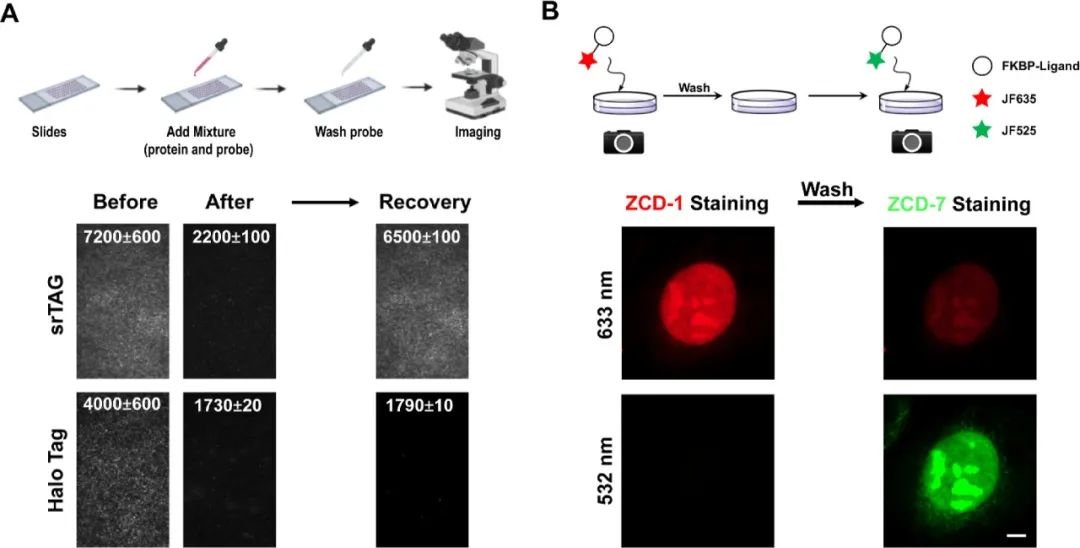 图5. srTAG 的 "开-蛋白""开/关 "平衡和可交换性的机理研究。(A) 生物素化的 FKBPF36L 或 HaloTag7 蛋白分别与 ZCD-1(1 μM)或 JF635-CA(500 nM)孵育,并固定在涂有链霉亲和素的盖玻片上。用 PBS 缓冲液(25 °C)广泛清洗固定的蛋白质-染料混合物,以去除未固定的蛋白质和染料分子。将盖玻片安装到 TIRF 显微镜上进行 FRAP 成像,在光漂白 3 分钟前后和恢复 10 分钟后拍摄荧光图像。共进行了三次重复,所有重复都表现出类似的行为。此处显示的是一组典型图像。(B) srTAG 在固定的 U2OS 细胞中的颜色转换。用 4% PFA 溶液固定表达 NLS-FKBPF36L 的细胞,并用 0.5% Triton X-100 进行渗透。首先用 10 μM ZCD-1(Ex:633 nm)标记,然后用 PBS 冲洗三次,再用 10 μM ZCD-7(Ex:532 nm)标记。图片为两个独立实验的代表。标尺:5 μm:5 μm。
图5. srTAG 的 "开-蛋白""开/关 "平衡和可交换性的机理研究。(A) 生物素化的 FKBPF36L 或 HaloTag7 蛋白分别与 ZCD-1(1 μM)或 JF635-CA(500 nM)孵育,并固定在涂有链霉亲和素的盖玻片上。用 PBS 缓冲液(25 °C)广泛清洗固定的蛋白质-染料混合物,以去除未固定的蛋白质和染料分子。将盖玻片安装到 TIRF 显微镜上进行 FRAP 成像,在光漂白 3 分钟前后和恢复 10 分钟后拍摄荧光图像。共进行了三次重复,所有重复都表现出类似的行为。此处显示的是一组典型图像。(B) srTAG 在固定的 U2OS 细胞中的颜色转换。用 4% PFA 溶液固定表达 NLS-FKBPF36L 的细胞,并用 0.5% Triton X-100 进行渗透。首先用 10 μM ZCD-1(Ex:633 nm)标记,然后用 PBS 冲洗三次,再用 10 μM ZCD-7(Ex:532 nm)标记。图片为两个独立实验的代表。标尺:5 μm:5 μm。
结论
作者报告了一种开发用于蛋白质成像的光稳定性 srTAG 的新策略。与常用的共价自标记相比,srTAG 具有更优越的光稳定性。srTAG 适用于标记不同的蛋白质,并适合具有不同光谱特性的荧光团。此外,与其他自标记标签或荧光蛋白相比,srTAG 的尺寸较小(12 kDa),在活细胞成像实验中不易干扰蛋白质的运输和分布。
参考文献
Du, Z.; Wang, W.; Luo, S.; Zhang, L.; Yuan, S.; Hei, Y.; Bao, Z.; Chen, C.; Lin, Y.; Chu, L. Self-Renewable Tag for Photostable Fluorescence Imaging of Proteins. J. Am. Chem. Soc. 2023, jacs.3c06102. https://doi.org/10.1021/jacs.3c06102.